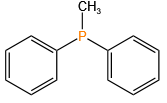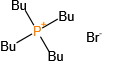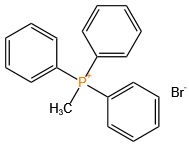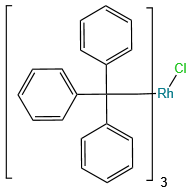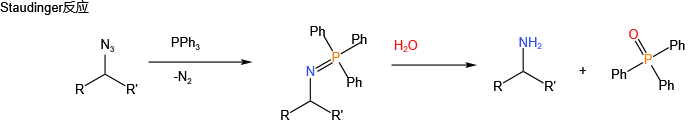有机磷化合物概述
有机磷化合物是指分子中含有碳-磷(C-P)键的一类有机化合物,在医药、农药、材料科学及有机合成中具有重要应用。
结构多样性
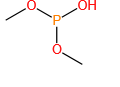
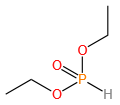
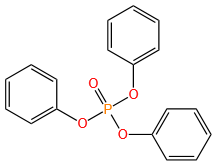
磷原子可形成多种价态(+3、+5)和配位数(3、4、5),衍生出膦、亚膦酸、磷酸酯等丰富的官能团。
应用广泛
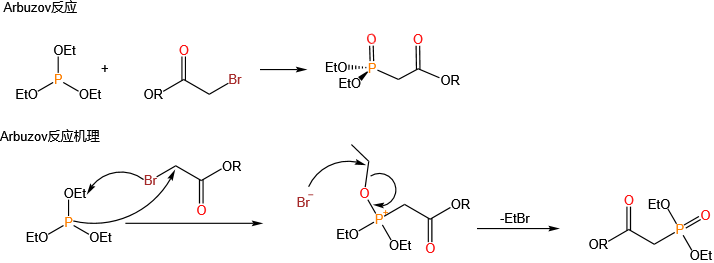
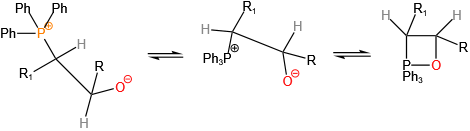
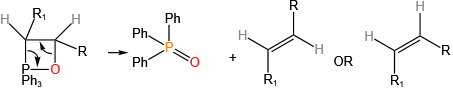
用于药物合成(如抗病毒药物)、农药(如对硫磷)、材料科学(如阻燃剂)及有机合成中的关键反应(如Wittig反应)。
历史意义
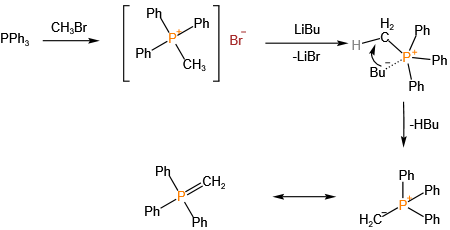
1954年发现的Wittig反应彻底改变了烯烃合成策略,其发现者Georg Wittig于1979年获得诺贝尔化学奖。
基本结构示例
三苯基膦 (Triphenylphosphine)
Ph₃P
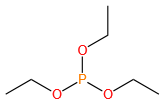
磷酸三乙酯 (Triethyl phosphate)
OP(OEt)₃